Среди органических соединений ведущую роль играют белки. Часто они в составе клеток преобладают и количественно. Так, в клетках животных белки составляют 40 — 50% сухой массы, а в клетках растений — 20 — 35%.
Строение и свойства аминокислот
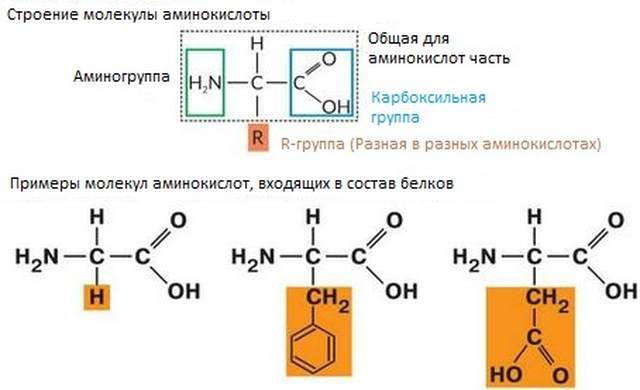
Аминокислоты — это органические вещества, молекулы которых содержат аминогруппу (-NH2 ), которая проявляет основные свойства и карбоксильную группу (-СООН) с кислотными свойствами. Эти группы соединены с одним и тем же атомом углерода. Ковалентными связями атом углерода соединен с двумя атомами водорода в аминокислоте, которая называется глицином. В молекулах других аминокислот один из атомов водорода замещен на определенную группу атомов. Ее называют заместителем и обозначают R. Именно этой группой атомов аминокислоты отличаются друг от друга. Структурная формула аминокислоты показана на рисунке. Сейчас известно более 100 аминокислот, но только 20 из них входят в состав белков. Различные комбинации этих 20 аминокислот обеспечивают огромное разнообразие белковых молекул.
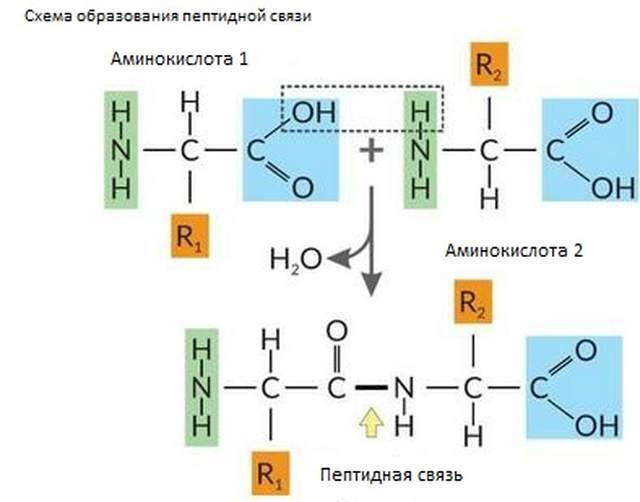
Поскольку в аминокислотах кислотные и основные свойства проявляют различные группы атомов, то их молекулы могут реагировать друг с другом с образованием прочной ковалентной связи, которая называется пептидной. При этом в образовавшемся веществе, с одной стороны остается аминогруппа, а с другой — карбоксильная, которые способны реагировать с другими аминокислотами. Поэтому удлинение такой цепи из аминокислот может происходить дальше. Молекула каждого белка характеризуется определенным составом и последовательностью аминокислотных остатков, которые придают ей неповторимые функциональные свойства.
Уровни структурной организации белковых молекул
Разнообразие строения белковых молекул обусловлена сложностью расположения их в пространстве. Выделяют несколько уровней структурной организации белковых молекул. Каждый белок образован линейным цепочкой из множества различных аминокислотных остатков, расположенных в определенном порядке и соединенных пептидными связями. Это первичный уровень структурной организации.
В водной среде клетки различные части длинной полипептидной цепи скручиваются и могут заключаться различными способами в спирали или складки. Это вторичный уровень структурной организации. Вторичная структура белка стабилизируется слабыми водородными связями между остатками аминокислот. Слабость связей компенсируется большим количеством, поэтому вторичные структуры являются относительно устойчивыми.
Сформированные таким образом спирали или складки укладываются в пространстве в различные третичные структуры (глобулы). Этот уровень организации белка стабилизируется сильными ковалентными и электростатическими взаимодействиями или слабыми водородными и гидрофобными.
Для выполнения своих функций некоторые белки должны состоять из нескольких суб-единиц, каждая из которых сформирована отдельной полипептидной цепью.
Объединение нескольких третичных структур в одну функциональную белковую молекулу формирует ее четвертичную структуру, которая, в отличие от первичной, вторичной и третичной, характерна не для всех белков. Процесс укладки полипептидных цепей во вторичную, третичную и четвертичную структуры является достаточно сложным и контролируется специальными белками. В случае ошибок в этом процессе сформирована белковая молекула может оказаться нефункциональной. Третичную и четвертичную структуру приобретают только длинные (более 50 аминокислот) полипептидные цепи. Короткие же (до 50 аминокислот) имеют простое строение и называются пептидами.
При определенных условиях (высокая температура, действие кислот, щелочей или ионов тяжелых металлов, ионизирующего излучения и т.д.) белковые молекулы теряют связи на уровне организации: четвертичные структуры распадаются на отдельные субструктуры, третичные структуры разворачиваются до уровня спиралей или складок, а те, в свою очередь, выпрямляются в полипептидные цепочки. Такой процесс потери белковыми молекулами естественной структуры называется денатурацией. Денатурированные белки не могут выполнять свои функции. В условиях непродолжительного или неинтенсивного влияния указанных факторов возможно возвращение белков к естественной структуры — ренатурация. В случае нарушения первичной структуры белковой молекулы процесс оказывается необратимым и называется деструкцией.
Кроме аминокислот белковые молекулы могут содержать и другие составляющие. Например, белок крови гемоглобин содержит небелковую часть гем с ионом железа внутри. Эта часть молекулы непосредственно связывает кислород, однако характер этой связки определяется именно белковой частью. Большинство мембранных белков и большое количество других связаны с углеводами. Такие комплексные молекулы называются гликопротеинами.
Ферменты являются биологическими катализаторами, которые существенно ускоряют химические реакции в организмах. Более подробно мы рассмотрим их в следующих статьях.
Рецепторные белки способны избирательно и очень точно распознавать определенные молекулы или их части. Благодаря активации рецепторных белков оказывают свое влияние гормоны, функционируют сенсорные системы и тому подобное.
Сигнальная функция белков заключается в том, что некоторые сигнальные вещества, а именно гормоны (вазопрессин, окситоцин, инсулин, тропные гормоны гипофиза) и медиаторы (вещества удовольствия — эндорфины) имеют белковую (пептидной) природу.
Транспортные белки способны связывать определенные вещества и переносить их: белок эритроцитов гемоглобин нужен для транспортировки кровью кислорода, мембранные белки-переносчики обеспечивают проникновение в клетку важных составляющих (глюкозы, ионов).
Защитная функция белков заключается в связывании вредных веществ, в частности токсинов, вырабатываемых болезнетворными организмами, и губительным воздействием на вирусы. К таким белкам относятся антитела и интерфероны. Белок плазмы крови фибрин участвует в свертывании крови.