Для начала выясним что такое элемент?
Элемент — это вещество, которое состоит исключительно из атомов одного вида.
Например кусок висмута содержит только атомы висмута, причем все они химически идентичны. Мы можем этот кусок размельчить кузнечным молотом, а затем размолоть в порошок. Однако каждый кусок, каждая отдельная частичка порошка — это все еще висмут. Мы можем нагревать его до тех пор, пока он не потечет как вода, или пока он не закипит, и каждый атом не вылетит в воздух. Но мы все еще будем иметь те же атомы химического элемента висмута и ничего более.
Большинство атомов способно соединяться с другими, образуя при этом молекулы. Атом одного химического элемента может соединяться с другими подобными атомами. Так, два атома кислорода образуют молекулу кислорода. Атом может также соединяться с одним или с несколькими атомами других элементов, образуя молекулы или химические соединения.
Удивительно в химическом процессе то, что при соединении двух различных атомов образуется совершенно иное вещество с новыми свойствами. Сильно воспламеняющийся газ — водород, соединяясь с кислородом, образует воду. Два ядовитых вещества: газообразный хлор и мягкий серебристо-белый металл натрий, соединяясь, образуют обычную столовую соль.
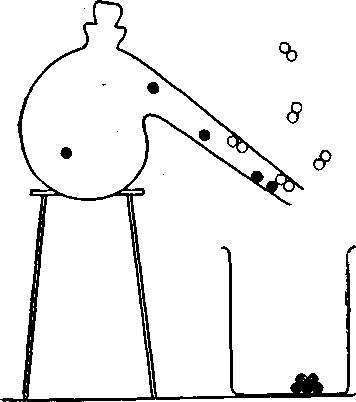
Другое хорошо известное соединение — сахар удается без труда разложить на более простые составные части. Для этого нужно положить некоторое количество сахара в реторту и нагреть ее. Вскоре молекулы сахара начнут распадаться. Образующийся черный остаток указывает на то, что сахар частично состоит из углерода. Другие атомы, которые были связаны в молекуле сахара, разъединяются, испаряются и конденсируются в виде капелек, которые стекают в стакан. Оказывается, эти капли — обычная вода. Мы можем пойти еще дальше и пропустить электрический ток через полученную воду, поместив ее в аппарат для электролиза. При этом молекула воды разлагается на водород и кислород, которые выделяются в виде отдельных пузырьков.
Сахар, таким образом, состоит из следующих химических элементов: углерода, водорода и кислорода. Каждая молекула сахара содержит 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.Значит, химическая формула сахара выглядит так: С12Н22О11.
В реторте мы имели дело с миллиардами миллиардов молекул сахара, но интересно выяснить, что же происходит с каждой молекулой в отдельности.
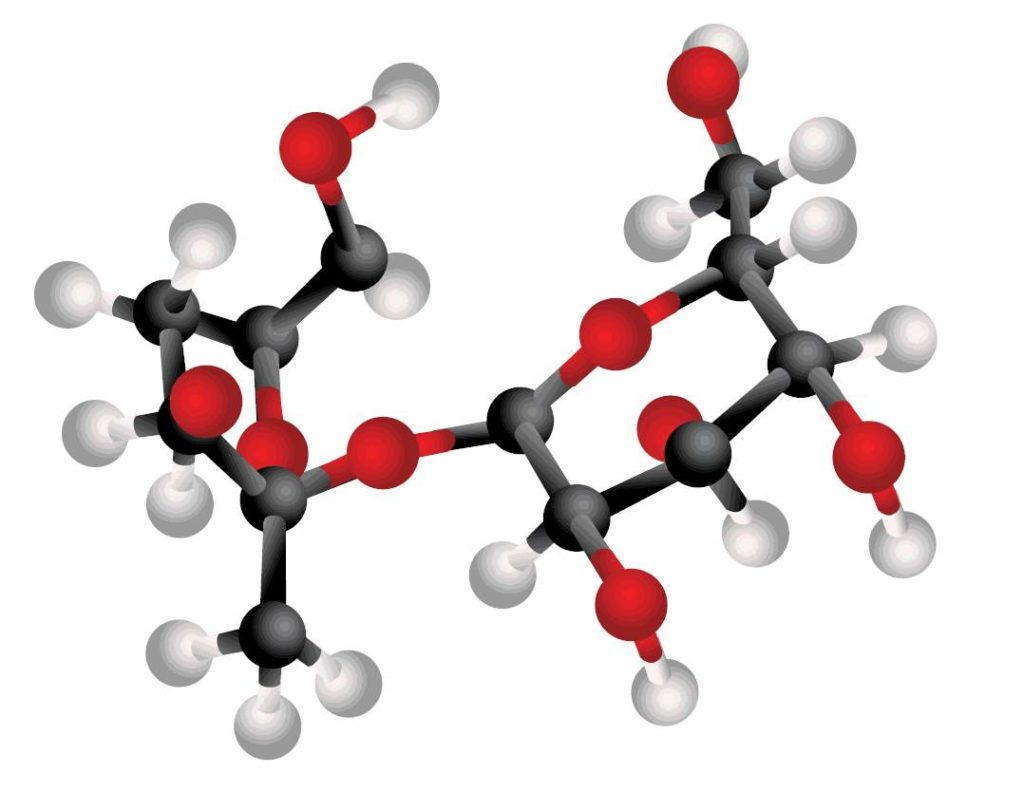
Наглядное представление об этом процессе можно получить с помощью модели.
Черные шарики изображают атомы углерода, белые — атомы водорода и красные — атомы кислорода. Палочки показывают химические связи, которые удерживают отдельные атомы элемента вместе. Это, конечно, не совсем та молекула сахара, которая оказалась бы на самом деле, если бы мы могли увидеть ее, но все же модель хорошо иллюстрирует общее расположение атомов внутри молекулы.
При нагревании молекула разлагается. 12 атомов углерода остаются на дне реторты, а 11 молекул воды переходят в пар. Этот результат можно выразить таким уравнением:
С12Н22О11 — 12С +11Н20.
Другими словами, из одной молекулы сахара образуется 12 атомов углерода и 11 молекул воды. Наконец, когда молекулы воды разлагаются, из них возникают 22 атома водорода и 11 атомов кислорода. Они соединяются парами, образуя 11 молекул водорода (Н2) и 51/2 молекул кислорода (О2) на каждую разложенную молекулу сахара.
Можно написать эту реакцию при помощи целых чисел, если удвоить число молекул воды, участвующих в реакции:
22Н2О — 22Н2 + 1102.
В другом эксперименте будем нагревать химическое соединение — окись ртути, представляющее собой порошок красного цвета. Название этого соединения говорит о том, что оно состоит из ртути и кислорода.
Вначале окись ртути изменяет окраску. Затем она закипает и начинает испаряться из колбы. Образовавшиеся газы, после того как они вырываются через шейку реторты, охлаждаются. Ртуть образует капли, которые собираются в стакане. Кислород также выделяется из реторты.
Мы не можем увидеть газообразный кислород, но зато сможем установить его присутствие, поднеся к реторте тлеющую деревянную лучинку. В атмосфере почти чистого кислорода лучинка загорается ярким пламенем.
Таким образом, нами установлено, что сухой красный порошок состоит из блестящего жидкого металла и газа, способного поддерживать горение. Молекула окиси ртути намного проще молекулы сахара. Она состоит всего лишь из двух атомов — ртути (символ которой — Hg) и кислорода. Это сразу видно из формулы окиси ртути: HgO.
При нагревании молекулы окиси ртути разлетаются в стороны, ударяются друг о друга или о стенки реторты. Каждая молекула разрушается, атом кислорода отскакивает от атома ртути.
Одиночные атомы ртути проходят через шейку реторты,, как обычный газ, и при охлаждении конденсируются в форме капелек. Атомы кислорода соединяются попарно и выделяются в виде газа. Этот процесс можно совсем просто записать с помощью химических символов:
HgO — Hg+O.
Однако, так как молекулы кислорода состоят из двух атомов, то свободный кислород, т. е. молекулу кислорода, надо обозначить символом О2. Так что мы должны поправить эту запись, заменив одну молекулу окиси ртути на две:
2HgO — 2Hg + 02
Это означает, что две молекулы HgO образуют два атома ртути и одну молекулу кислорода, которая, естественно, содержит два атома кислорода. Таким образом, окись ртути, как и сахар, является скоплением одинаковых молекул, каждая из которых построена из атомов более чем одного сорта.
Пять чистых жидкостей, которые мы испытывали ранее, также были простыми соединениями (точнее, последняя из них была раствором двух соединений). Кстати, все пять жидкостей состояли только из газообразных или из газообразных и твердых элементов. Эти жидкости:
- Вода (водород и кислород).
- Ацетон (водород, кислород и углерод) — та жидкость, которая воспламенялась.
- Четыреххлористый углерод (углерод и хлор) — та жидкость, которая гасила пламя.
- Азотная кислота (водород, кислород, азот) — та, которая химически реагировала с медной пластинкой.
- Раствор кобальта-60 (вода плюс нитрат, азот и кислород, радиоактивного кобальта) — та, которая заставляла счетчик Гейгера трещать, как пулемет.
Для получения пяти различных жидкостей было использовано всего шесть элементов. Но даже если взять всего два элемента — водород и углерод, то из них можно получить тысячи различных соединений, в частности парафин, керосин, пластмассы.
Свойства таких углеводородов зависят только от относительного числа атомов углерода и водорода в каждой молекуле, а также от способа, по которому атомы соединяются вместе.
Химические формулы для различных углеводородов сразу показывают нам числа атомов углерода и водорода в каждой молекуле. Например, СН4 — это метан. А вот и некоторые другие соединения:
- С2Н2 — ацетилен,
- С2Н4 — этилен,
- С8Н18 — октан,
- C10H18 — декагидронафталин.
Конечно, нужно взять много квадриллионов молекул, чтобы получить видимые или весомые количества углеводорода или какого-либо другого соединения. Ведь размер атома углерода порядка одной пятидесятимиллионной сантиметра.
Свойства атомов химических элементов
Что же касается атомного ядра, то оно еще меньше атома: диаметр атома превосходит диаметр его ядра примерно в десять тысяч раз. Если мы представим себе атом углерода увеличенным до размеров футбольного поля, то электроны будут похожи на мух, летающих над стадионом, а ядро — на футбольный мяч, причем этот мяч будет а тысячи раз тяжелее всех мух (т. е. электронов) вместе взятых.
Это означает, что более 99,9% всего вещества Вселенной сконцентрировано в очень маленьких ядрах атомов. И таким образом, атом является в основном пустым пространством.
О весе атома можно получить представление, основываясь на том, что равные объемы всех простых газов и паров содержат одинаковое число молекул. Если мы на каждую чашку весов положим колбы горловинами вниз, мы уравновесим один литр воздуха другим. Если теперь одну из колб наполнить водородом, вытеснив из нее воздух, то разница в весах этих колб покажет, насколько литр воздуха тяжелее литра водорода.
Можно пересчитать это на одну молекулу — путем очень длинного деления. Ведь известно, что в каждой колбе имеется одинаковое число молекул — примерно 26 870 000 000 000 000 000 000.
Число атомов будет вдвое больше, ибо свободные азот и кислород (основные компоненты воздуха), как и водород, имеют по два атома в молекуле.
Равные объемы некоторых металлов также весят по-разному, в зависимости от весов их атомов* Например, одинаковые кубики магния, железа, свинца и урана, подвешенные на одинаковых резинках, растянут их на разную длину.
Это, однако, дает только приблизительное представление об относительных весах атомов. Получить же их точные веса несравненно труднее: надо знать, насколько тесно атомы твердых элементов упакованы в различных материалах. Действительные атомные веса, взятые относительно веса атома кислорода, принятого равным 16, указаны в периодической системе. Они приблизительно равны: 238 — для урана, 207 — для свинца, 56 — для железа и 24 — для магния.
Следовательно, атом урана весит приблизительно столько, сколько весят 238 атомов водорода или 15 атомов кислорода.
Таково одно из многих сведений, содержащихся в периодической таблице. Периодическая таблица указывает также основные данные, которые необходимы для выяснения того, как атомы соединяются между собой.
Строение атомов химических элементов
Начнем с первого элемента — водорода, потому что его ядро представляет собой всего-навсего один протон. А протоны, как нам уже известно, являются основными частицами, из которых состоят ядра всех других элементов.
Каждый материальный объект во Вселенной состоит из атомов одного или более элементов. Общее число элементов немного больше ста, так что мы будем правы, если назовем атомы химическтх элементов строительными кирпичиками материи.
Но все элементы построены из одних и тех же основных ( фундаментальных ) частиц — протонов, нейтронов и электронов. Что же делает один элемент отличным от другого? Не что иное, как число протонов, нейтронов и электронов, входящих в его состав.
Протон — это частица с единичным зарядом положительного электричества. Он в то же время является ядром атома водорода и составляет более 99,9% его атомного веса.
Итак, ядро водорода — протон имеет заряд 1, как можно видеть из периодической таблицы, в которой указано, что атомный номер водорода равен 1. Мы можем изобразить его в виде кружочка со знаком +. Если мы добавим к протону вторую частицу такого же веса, но без электрического заряда, то такая система будет иметь вес, равный двум. Но ее заряд остается равным 1, так как в ней имеется только один протон. Нейтральная частица — нейтрон имеется в ядре каждого элемента, за исключением обычного водорода. Если теперь добавить сюда второй протон и второй нейтрон, то получится сложная частица с зарядом 2 и весом 4.
Из периодической таблицы нетрудно установить, что эта частица представляет собой ядро атома гелия, у которого атомный номер равен 2, а массовое число — 4. Массовое число — это общее число протонов и нейтронов, т. е. это атомный вес элемента, округленный до целого числа.
Если мы добавим к ядру гелия третий протон и третий нейтрон, то получим ядро лития, называемое литием-6. Это ядро имеет положительный заряд 3 и массовое число 6.
Наиболее распространенной формой этого серебристо-белого металла является литий-7, в состав которого входит еще один нейтрон. 92% природного лития состоит из лития-7, имеющего атомный вес 7,02 и массовое число 7. Средний же атомный вес природного лития (содержащего литий-6 и литий-7) равен 6,940.
Прибавляя протоны и нейтроны к этому ядру, мы будем получать ядра все более тяжелых элементов.
Но атом не станет атомом до тех пор, пока ядро не будет окружено соответствующим числом электронов — по одному электрону на каждый протон. Электрон — это единичный заряд отрицательного электричества, и он точно уравновешивает положительный заряд протона.
Таким образом, атом водорода состоит из одного протона и единственного электрона, вращающегося вокруг него.
Для атома химического элемента гелия потребуются два электрона, чтобы уравновесить положительный заряд 2, обусловленный его двумя протонами. Для атома характерно то, что только строго определенное число электронов может находиться на каждой данной орбите, или оболочке. Орбита, ближайшая к ядру, может иметь только два электрона. В этом случае считается, что первая оболочка заполнена, и далее начнет заполняться следующая орбита, на которой может находиться 8 электронов. Так, в атоме лития, как и в атоме гелия имеются два электрона на первой оболочке и, кроме того, третий электрон, одиноко вращающийся на внешней орбите.
В действительности орбиты трехмерны, а электроны движутся по поверхности воображаемой сферы. Причем их реальные пути намного сложнее, чем можно представить себе из нашего упрощенного описания.
Рассмотрев следующие семь элементов, мы обнаружим, что у них постепенно заполняется вторая оболочка. Последний из них, неон, имеет 10 протонов в ядре и 10 электронов на двух оболочках.
В атоме неона вторая оболочка с ее восемью свободными местами заполнена до предела. Внутренняя, двухэлектронная оболочка, конечно, тоже заполнена. Таким образом, неон, подобно гелию, является также «укомплектованным» атомом — в нем нет свободных мест или внешних, избыточных электронов.
После неона идет натрий, имеющий 11 протонов и 11 электронов. Одиннадцатый электрон одиноко вращается на третьей оболочке. Натрий, который в периодической таблице помещен непосредственно под литием и водородом, имеет, так же как и они, единственный электрон на своей внешней орбите.
Теперь мы начинаем понимать, почему мы говорим — периодическая таблица элементов. Мы установили, что определенные свойства атомов периодически повторяются, если располагать элементы по порядку возрастания их атомных номеров.
Важно, что каждый раз, когда к ядру прибавляется один протон, атом также должен получить и один дополнительный электрон. Этот электрон, обычно помещаемый на внешнюю орбиту, необходим для того, чтобы сохранить электрическую нейтральность атома в целом.
Следовательно, от числа протонов в ядре зависит количество электронов, вращающихся вокруг ядра. В нейтральном атоме должно находиться всегда одинаковое число протонов и электронов.
Число этих электронов и характер их размещения на возможных орбитах — это и определяет химические свойства любого данного элемента. Химические свойства просто означают, как элемент должен соединяться (или отказываться соединяться) с другими элементами. Они указывают также на то, насколько легко элемент должен соединяться и насколько устойчиво будет это соединение.
Химические свойства зависят от числа и расположения электронов в атоме и никак не связаны с протонами и нейтронами, находящимися в самом ядре.
Число нейтронов в атомном ядре, однако, различно для различных изотопов одного и того же элемента. Слово изотоп означает: занимающий то же самое, или равное (iso), место (topos). Изотопы элемента занимают одно и то же место в периодической системе и имеют одинаковое число протонов и электронов. Хорошим примером может служить природный литий, который содержит два изотопа: литий-6 и литий-7.
Главное, что отличает изотопы,— это их разные атомные веса, а нередко и радиоактивность.
Если мы возьмем атом водорода (протон с вращающимся вокруг него электроном) и добавим к его ядру нейтрон, то нам нет нужды прибавлять электрон: нейтрон не имеет заряда и не нуждается в электроне для сохранения электронейтральности атома. А так как мы не изменили числа электронов, то не изменили и химических свойств атома.
Единственное, что изменено, так это вес атома. У водорода имеется три изотопа: обычный водород, содержащий только протон в ядре; дейтерий, который имеет еще нейтрон, и поэтому его атомный вес равен 2; наконец, радиоактивный тритий, который имеет вес примерно три атомных единицы и содержит 1 протон и 2 нейтрона в ядре.
Природный уран — это, главным образом, изотоп U-238 с 92 протонами и 146 нейтронами в ядре. Но в природном уране содержится и другой хорошо известный изотоп U-235, способный к делению и служащий поэтому источником атомной энергии. U-235 имеет также 92 протона, но только 143 нейтрона, т. е. три единицы меньше атомного веса U-238. Наличие изотопов означает, что мы были не совсем точны, когда определяли элемент как вещество, все атомы которого идентичны.
Ядро атома трехмерное, а не плоское, каким мы его изображали. Некоторые ядра имеют почти сферическую форму, подобно футбольному мячу. Зато другие, в частности уран, более похожи на мяч для игры в регби (по форме он напоминает дыню).