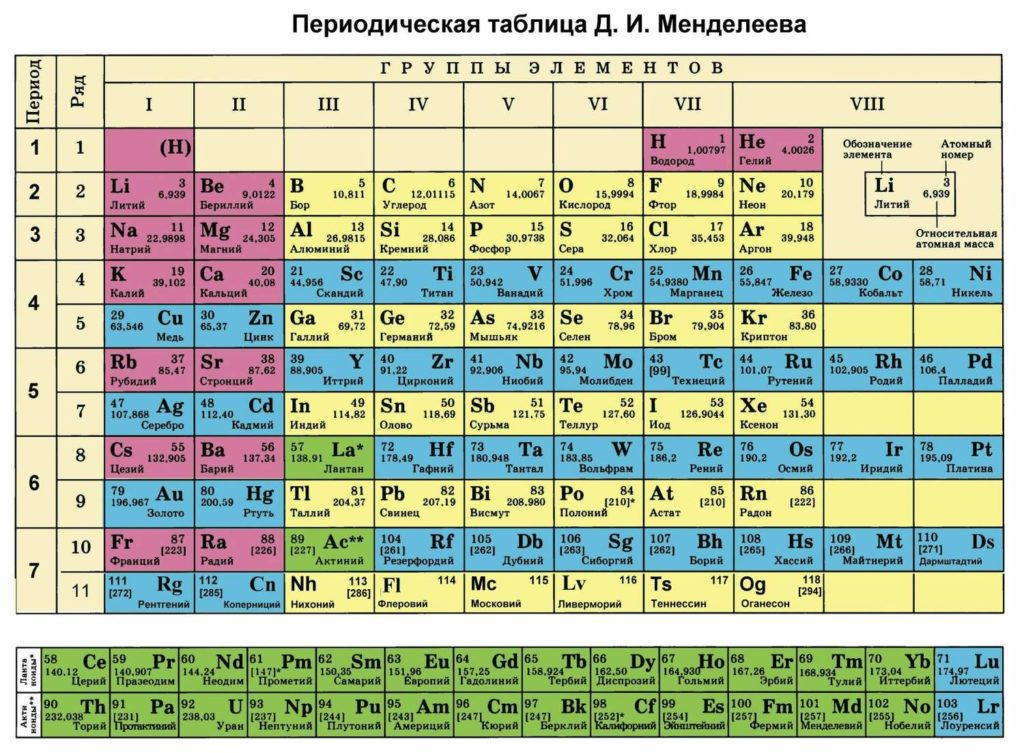
Основными характеристиками атома, которые определяют его поведение в химических реакциях и при образовании простых веществ, является строение внешнего электронного слоя и энергия электронов относительно положительно заряженного ядра. Обе характеристики подлежат периодической зависимости от порядкового номера элемента, который всегда указывается в периодической таблице элементов.
Согласно современным квантово-механическими представлениями конфигурация электронной оболочки определяется зарядом ядра атома и положением элемента в периодической системе. Как уже установлено, электроны с одинаковым значением главного квантового числа образуют квантовые уровни, емкость которых увеличивается по мере удаления от ядра. Квантовые уровне, в свою очередь, построенные из подуровней, объединяющих электроны с одинаковым значением орбитального квантового числа. А подуровни состоят из орбиталей, на каждой из которых может находиться не более двух электронов.
Распределение электронов в атоме выражают с помощью электронной формулы (условного записи распределения электронов в атоме с помощью квантовых чисел) и электронно-графической схемы — квантовых ячеек, в которых клеточка символизирует орбиталь, а стрелка — электрон.
Таблица 1 — Электронное строение атомов элементов первых трех периодов
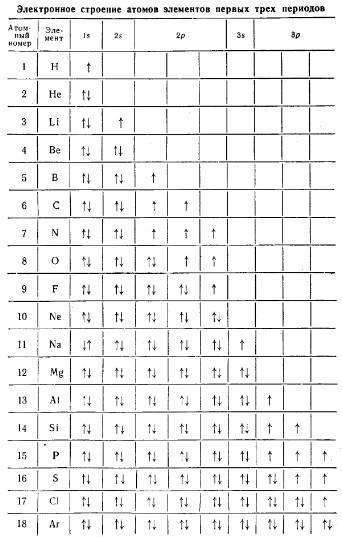
В электронных формулах цифрами указывают номер энергетического уровня, латинскими буквами — энергетические подуровни, а цифрами вверху справа — количество электронов на подуровне. Например, условная запись 5d4 означает, что на d-подуровне пятого энергетического уровня размещаются четыре электрона.
При составлении электронной формулы атома любого элемента полезно помнить несколько очевидных закономерностей:
Общее количество энергетических уровней (а следовательно, и номер внешнего уровня) определяется значением главного квантового числа n и соответствует номеру периода, в котором размещается элемент.
Например, элемент магний (порядковый номер 12) находится в третьем периоде периодической системы элементов, поэтому двенадцать электронов атома Mg размещаются на трех энергетических уровнях. При этом третий, наиболее удаленный от ядра уровень является внешним, для него главное квантовое число n = 3.
Энергетические уровни расщепляются на энергетические подуровни, для описания которых используются буквенные обозначения орбитального квантового числа l. Количество энергетических подуровней на данном уровне совпадает с номером этого уровня и определяется значением главного квантового числа n (или количеством значений орбитального квантового числа l).
Таким образом, на первом энергетическом уровне (для которого n = 1) существует только один подуровень 1s (напомним: для s-подуровня орбитальное квантовое число l = 0), на втором — два подуровня (2s и 2p), на третьем — три (3s, 3p, 3d), на четвертом — четыре (4s, 4p, 4d, 4f) и т.д.
Энергетические подуровни состоят из орбиталей. Количество орбиталей на энергетическом подуровне определяется количеством значений магнитного квантового числа m, равное (2l + 1).
Графически орбитали изображаются в виде квантовых ячеек, каждая из которых имеет форму небольшого квадратика. Орбитали одного энергетического подуровня изображаются слитно:

Элементы малых периодов
В первых трех периодах, которые называются малыми (или типичными), с увеличением заряда ядра происходит заполнение электронами внешнего энергетического уровня, номер которого совпадает с номером периода в периодической системе.
Первый период состоит из двух элементов. У атома водорода один электрон размещается на единой орбитали s-подуровня первого энергетического уровня (n = 1). Электронная формула водорода записывается:

В соответствии с принципом Паули на s-орбитали может находиться два электрона с антипараллельными спинами, поэтому электронная формула атома гелия имеет следующий вид:

Благодаря такому размещению электронов образуется устойчивая конфигурация, которая определяет химическую инертность гелия. В атоме гелия завершается застройка ближайшего к ядру первого энергетического уровня.
Элементы, в атомах которых застраивается электронами s-орбитали внешнего энергетического уровня, называются s-элементами.
Все s-элементы объединяются в s-электронную семью, которая в периодической системе элементов размещается в двух первых группах, за исключением s-элемента гелия Не, который традиционно зачисляют в VIII группу благодаря его принадлежности к инертным элементам.
У элементов второго периода происходит заполнение второго энергетического уровня (второй энергетический уровень, n = 2): сначала заполняется 2s-орбиталь, а затем последовательно три 2р-орбитали. Для упрощения на электронных схемах указываются только полностью заполненные энергетические уровни, например
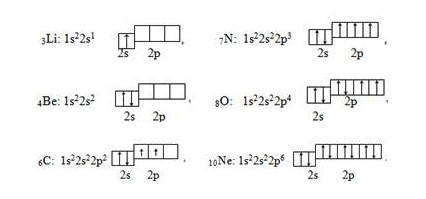
Элементы Li и Be относятся к s-электронной семьи, поскольку в их атомах именно на s-подуровень поступает последний электрон — так называемый формообразующие электрон (или просто формирующий ), то есть, который определяет принадлежность атома к элементам конкретной электронной семьи. В следующих шести элементах, начиная от карбона 6С и заканчивая неоном 10Ne, формирующие электроны заполняют р-подуровень ( l = 1) второго энергетического L-уровня (n = 2).
Элементы, в атомах которых заполняются электронами р-орбитали внешнего энергетического уровня, называются р-элементами.
Cовокупность всех р-элементов составляет р-электронную семью. Р-элементы размещаются в III-VIII группах периодической системы Д.И.Менделеева.
Для s- и р-элементов присуща интересная особенность: количество внешних (валентных) электронов равно номеру группы. Справедливо и обратное утверждение: по количеству валентных электронов в атомах можно установить, в какой группе находится данный элемент.
Третий период, в котором проходит застройка третьего энергетического уровня (n = 3), как и второй, содержит восемь элементов: два s-элемента (Na, Mg) и шесть р-элементов (Al, Si, P, S, Cl, Ar ), причем конфигурация внешнего энергетического уровня соответствующих элементов второго и третьего периодов аналогична. Например, у элементов VII группы фтора и хлора заполнения электронами внешних энергетических уровней происходит подобным образом, что хорошо видно при сравнении электронных формул:
![]()
Благодаря одинаковой электронной конфигурации внешнего электронного слоя, для изображения внешнего энергетического уровня элементов F и Cl можно использовать общую формулу ns2 np5 , где n — значение главного квантового числа для внешнего уровня и одновременно номер периода.
Элементы с одинаковой электронной конфигурацией внешнего энергетического уровня называются элементами-аналогами .
Необходимо помнить, что у элементов третьего периода остается свободным 3d-подуровень.
Элементы больших периодов
Четвертый и пятый периоды содержат по восемнадцать элементов. В атомов элементов четвертого периода происходит застройка четвертого энергетического уровня (n = 4), начиная с 4s-орбитали. Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловлено экранированием ядра электронами, образующими плотный и симметричный слой 3s2 3p6. В связи с отталкиванием от этого слоя для формообразующего девятнадцатого электрона атома калия (№19) и формообразующего двадцатого электрона атома кальция (№20) наиболее выгодным является 4s-состояние:

Застройка электронами внешнего 4s-подуровня атомов К и Са при наличии свободного 3d-подуровня согласуется с первым правилом Клечковского: сумма главного n и орбитального l квантовых чисел для 4s-подуровня меньше, чем для 3d:
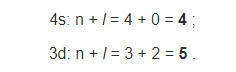
А согласно второму правилу Клечковского после 4s-подуровня, несмотря на одинаковую сумму (n + l = 5), будет заполняться электронами 3d, а не 4p, поскольку именно 3d имеет меньшее значение главного квантового числа:
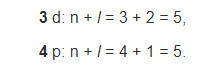
Итак, в десяти элементов — от скандия ( 21Sc) до цинка ( 30Zn) происходит заполнение электронами 3d-подуровня. Для сокращения записи электронных формул в квадратных скобках указывается символ предыдущего инертного элемента (в данном случае аргона Ar), что означает его электронную структуру, которая совпадает с электронными структурами внутренних электронных слоев рассматриваемого элемента. К примеру:
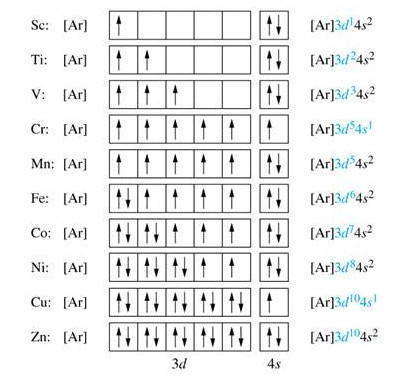
Элементы, в атомах которых заполняются d-орбитали второго снаружи энергетического уровня, называется d-элементами.
Электронная семья d-элементов, в атомах которых проходит заполнения электронами второго извне d-подуровня, размещаются в боковых подгруппах периодической системы Д.И.Менделеева.
Как показал анализ, в атомах некоторых d-элементов наблюдается самовольное перемещение электронов с n s-подуровня на ( n-1 ) d-подуровень. Такое явление называется проскоком электронов. Оно связано со стремлением атома иметь энергетически устойчивую конфигурацию, которой соответствуют полностью или наполовину застроенные электронами энергетические подуровни. Так, для атома хрома наблюдается процесс, когда электрон с 4s-подуровня переходит на 3d. Это приводит к энергетической стабилизации атома: 24Cr: [Ar] 4s1 3d5 .
В атоме элемента медь происходит такой же проскок электрона с 4s-подуровня на 3d: 29Сu: [Ar] 4s1 3d10. В результате на внешнем уровне атома Сu остается только один электрон — именно этим объясняется, почему медь размещается в первой группе периодической системы в отличие от следующего элемента цинка ( 30Zn: [Ar] 4s2 3d10 ), который имеет два электрона на внешнем энергетическом уровне, что и определяет его принадлежность ко второй группе периодической системы.
Итак, четвертый период начинается 4s-элементами (двумя) и заканчивается 4р-элементами (шестью), а между ними располагаются десять 3d-элементов, в которых заполняется второй снаружи d-подуровень.
В пятом периоде заполнение энергетических уровней и подуровней происходит аналогично четвертому периоду, а именно: у атомов двух первых элементов ( 37Rb и 38Sr) застраиваются 5s-орбитали, у атомов следующих десяти (от 39Y до 48Cd) — 4d- орбитали, а еще в шести (от 49In до 54Xe) — 5p-орбитали. Надо отметить, что в пяти d-элементов пятого периода ( 41Nb, 42Mo, 44Ru, 45Rh, 47Ag) тоже, как и у атома хрома в четвертом периоде, наблюдается проскок одного, а в 46Pd — даже двух электронов с внешнего 5s-подуровня на предыдущей 4d-подуровень. Примеры электронных формул элементов пятого периода:
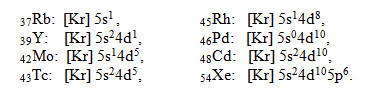
Шестой период , содержащий 32 элемента, начинается двумя s-элементами ( 55Cs, 56Ba), в атомах которых заполняется 6s орбиталь. В следующем элемента, лантанеа, формирующий, пятьдесят седьмой, электрон поступает на 5d-орбиталь (5d: n + l = 5 + 2 = 7), вопреки второму правилу Клечковского, вместо того, чтобы заполнять 4f-подуровень (4f: n + l = 4 + 3 = 7). Это явление обусловлено более резким уменьшением энергии 4f-электронов с ростом заряда ядра по сравнению с энергией 5d-электронов. Поэтому в 57La энергия 5d-электронов ниже, а в 58Се выше, чем энергия 4f-электронов. Но в следующих четырнадцати элементах от 58Се до 71Lu состояние 4f энергетически более выгодно, чем состояние 5d, поэтому в их атомах происходит застройка 4f-орбиталей.
Элементы, в атомах которых заполняются электронами f-орбитали третьего снаружи уровня, называются f-элементами.
Далее, начиная с 72Hf, продолжается заполнение 5d-орбиталей в десяти элементах до ртути 80Hg включительно. Период заканчивается р-элементами ( 81Tl — 86Rn), в атомах которых застраивается 6р подуровень. Проскоки электронов с внешнего 6s-подуровня на предыдущий 5d-подуровень наблюдаются в двух элементах: платине 78 Pt и золоте 79 Au. Примеры электронных структур элементов шестого периода:
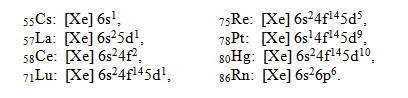
Таким образом, шестой период состоит из двух s-элементов, шести р, десяти d- и четырнадцати f-элементов.
Седьмой период еще не завершен. Заполнение энергетических уровней и подуровней происходит в нем подобно тому, как и у атомов элементов шестого периода. Период начинается двумя s-элементами ( 87Fr, 88Ra ). За ними следуют d-элементы ( 89Ас, 90Th ), а затем тринадцать f-элементов ( 91Ра — 103Lr). Завершают периодическую систему d-элементы. Примеры электронных конфигураций элементов седьмого периода:
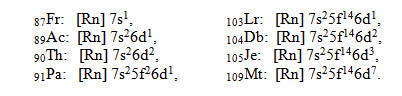

Глупость человеческая беспредельна — людям внушили про «Великое менделеевское открытие» и все, как попугаи, повторяют один и тот же бред.
Имейте разум: если электронная структура атомов и менделеевская таблица во многом совпадают, то напрашивается элементарный логический вопрос: а может быть они совпадают полностью? Это нетрудно сделать — дайте электронам порядковые номера.
После этого ничего учить не надо будет — достаточно одного урока.
А вот в фундаментальном смысле открываются двери в новый виток НТП.