Еще до открытия галлия, скандия и германия спектроскоп позволил эффектно обнаружить другой неизвестный элемент.
Во время солнечного затмения в 1868 г. спектроскоп был впервые использован для разложения и изучения света, испускаемого хромосферой — накаленной солнечной атмосферой.
Открытие гелия
Французский астроном Жансен обнаружил яркую желтую линию в солнечном спектре. Две другие желтые линии легко распознавались как линии натрия. Новая линия, видимо, принадлежала какому-то другому элементу и до того никогда не наблюдалась. Вскоре выяснилось, что эта особая желтая линия света создается неизвестным элементом, находящимся на Солнце. Элемент был назван гелием (по-гречески Солнце — Гелиос). Сведения о существовании гелия на Земле появились только спустя двадцать семь лет после этого открытия.
В то время для гелия не было места в периодической таблице Менделеева, точнее, в том ее виде, который она имела в 1870—1880 гг. Открытие гелия на Земле поставило вопрос о включении его в периодическую систему. В 1880-е годы профессор физики лорд Рэлей работал в Кавендишской лаборатории Кэмбриджского университета в Англии. Он несколько лет занимался исследованиями плотности газов, особенно интересовал его азот.
Открытие аргона
Рэлей обнаружил, что азот, приготовленный из аммиака, имеет плотность на 0,5—1% меньшую, чем азот, который он извлекал из воздуха.
Почему?
Это различие было, в сущности, небольшим, и большинство ученых считало, что не следует заниматься этим вопросом. Однако химик Уильям Рамзай считал, что этот факт заслуживает дальнейшего изучения, и, получив от Рэлея разрешение, он продолжил его работу. Рамзай взял определенное количество воздуха и удалил из него кислород. Затем удалил азот. Однако все еще оставался небольшой остаток. Оставшийся газ Рамзай поместил в стеклянную трубку и возбудил его, пропустив через трубку электрический ток. Исследовав накаленный газ с помощью спектроскопа, он обнаружил несколько новых линий, не принадлежавших ни одному из известных элементов.
Странным было то, что в периодической системе не было предусмотрено место для нового газообразного элемента.
Однако в 1894 г. Рамзай выдвинул идею, что может существовать целая вертикальная колонка элементов, пропущенных в периодической системе. Ни один из этих элементов не был известен Менделееву, и поэтому великий русский химик не имел ключа, который позволил бы предположить существование еще одной колонки элементов.
Рамзай считал, что, вероятно, открытый им газ будет первым в колонке новых элементов; эта колонка показана здесь в рамках современной периодической таблицы, но в нее включены лишь известные в то время элементы.
Он назвал открытый им газ аргоном, что означает по-гречески «ленивый», или «недеятельный». Причиной для этого названия послужило то обстоятельство, что аргон вовсе не обладает химическими свойствами. Этот газ не имеет ни цвета, ни запаха или вкуса и не вступает в реакцию с другими элементами.
Открытие неона, криптона и ксенона
В следующем году Рамзай открыл другой новый газ, который выделялся при нагревании редкого минерала клевеита. Изучив спектр этого газа, ученый обнаружил, что он совершенно аналогичен спектру солнечного гелия. Рамзай продолжал свои исследования воздуха вместе со своим юным студентом М. Траверсом. Вскоре они выделили гелий из воздуха, а затем приступили к поискам других газов, похожих на аргон.
Они стали перегонять жидкий воздух.
Различные составные части (компоненты) жидкого воздуха могут отделяться друг от друга при кипении, потому что каждая из них имеет свою температуру кипения. Например, азот из жидкого воздуха выкипает раньше кислорода. Этот процесс называется фракционной перегонкой и является основным методом разделения компонентов нефти.
Рамзай и Траверс возбуждали полученный газ в разрядной трубке и затем анализировали свет при помощи спектроскопа, который позволил бы им найти новые элементы, если бы они действительно были бы выделены. В течение очень короткого времени они обнаружили три новых элемента и назвали их соответственно неоном (значит «новый»), криптоном («скрытный») и ксеноном ( «незнакомый» ).
Все три элемента были такими же инертными, как и «ленивый» аргон. Они теперь называются редкими или инертными газами. Последний из инертных газов был открыт в 1900 г. Эрнстом Дорном. Было известно, что при радиоактивном распаде радия образуется газ. Но именно Дорн установил, что этот газ и есть последний и самый тяжелый член нового семейства. Этот газ также оказался радиоактивным, и его назвали радоном.
Значение инертных газов
Инертные газы нашли широкое применение, в частности, именно благодаря их инертности. Первый опыт промышленного производства гелия застал англичан врасплох: однажды немецкий военный дирижабль был обстрелян зажигательными пулями, но не загорелся. Этот дирижабль, очевидно, был наполнен гелием вместо легко воспламеняющегося водорода.
Хотя гелий и является наиболее легким элементом после водорода, он обладает совершенно иными свойствами. Водолазы дышат теперь смесью кислорода и гелия, а не кислородоазотной смесью обычного воздуха. Азот растворяется в крови водолазов и вызывает «кессонную болезнь»; гелий же растворяется в значительно меньшей степени.
Еще в 1903 г. Рамзай показал, что гелий является продуктом радиоактивного распада радия. В эксперименте Рамзая впервые было обнаружено превращение одного элемента в другой. В настоящее время гелий используется в качестве источника бомбардирующих частиц в современных атомных машинах — ускорителях. Ядро гелия, лишенного двух атомных электронов, представляет собой обычный продукт радиоактивного распада; оно носит название альфа-частицы. Аргон применяется при сварке, так как он инертен и, следовательно, предохраняет металлы от окисления во время сварки. Аргон используется также для наполнения счетчиков Гейгера и ламп накаливания. Аргон, неон и некоторые другие инертные газы используются в наших «неоновых» вывесках и рекламах. Различные окраски в них получаются в результате того, что внутренняя поверхность стеклянных трубок покрывается различными флуоресцирующими веществами, а также благодаря наполнению трубки той или иной смесью инертных газов.
Свойства инертных газов
Совершенно невероятным может показаться то, что эти газы вообще не обладают химическими свойствами. Они не соединяются и не реагируют ни с какими другими элементами ). Это странное поведение — отсутствие каких-либо химических свойств — связано с электронной структурой их атомов.
В атоме натрия имеется внутренняя оболочка из двух электронов и еще один электрон, расположенный над этой заполненной оболочкой, который также вращается вокруг ядра. Натрий — чрезвычайно активныи и потому опасный, активность обусловлена наличием этого единственного внешнего электрона.
У элемента, находящегося в периодической таблице перед натрием, нет активного внешнего электрона; именно такая симметричная картина расположения электронов имеет место в атоме неона. Оболочка из восьми электронов, как и внутренняя оболочка, состоящая из двух электронов, полностью заполнена. Можно сказать, что неон, попросту говоря, не заинтересован в обмене. Он не склонен к захвату электронов от каких-то других атомов и не имеет таких внешних электронов, которые можно было бы отдать другим атомам. Таким образом, неон почти совсем не обладает химическими свойствами.
Если взять атом, у которого имеется на один электрон меньше, чем у неона, то у такого атома будет одно свободное место в его внешней оболочке. Так обстоит дело в случае фтора, который сильно стремится заполучить недостающий внешний электрон, чтобы заполнить свою внешнюю оболочку. Поэтому фтор, подобно натрию, также один из наиболее активных элементов.
Инертные, или редкие, газы действительно очень редки на Земле; в частности, из-за этого они и были открыты значительно позднее других элементов. Они заняли в периодической таблице вертикальную колонку, которую Менделеев не мог предсказать.
Открытие редкоземельных элементов
Одновременно с галлием (Ga), скандием (Sc), германием (Ge) и фтором (F) были открыты еще восемь новых элементов, относящихся к группе «редкоземельных»: иттербий (Yb) в 1878 г., самарий (Sm), гольмий (Но) и тулий (Ти) в 1879 г., празеодим (Рг) и неодим (Nd) в 1885 г., гадолиний (Gd) и диспрозий (Dy) в 1886 г. Полоний (Ро) и радий (Ra) были открыты в 1898 г., а затем последовали актиний (Ас) в 1899 г., европий (Ей) в 1901 г., лютеций (Lu) в 1907 г. и протактиний (Ра) в 1917 г.
Лантан и другие четырнадцать «редкоземельных» элементов, называемых лантанидами (потому что все они подобны лантану), находятся в периодической системе между барием и гафнием. Для удобства они помещены внизу в отдельном ряду. «Редкими землями» их назвали из-за сходства с известью и магнезией, которые когда-то называли «землями».
Актиний и актинидные элементы (торий и другие) также помещены отдельно внизу таблицы. Каждый актинидный элемент подобен, с одной стороны, актинию, а с другой — лантанидному элементу, с которым он образует пару. Открытие гафния (Hf) в 1923 г. и рения (Re) в 1925 г. дополнило периодическую таблицу, после чего вплоть до урана осталось только четыре свободных места.
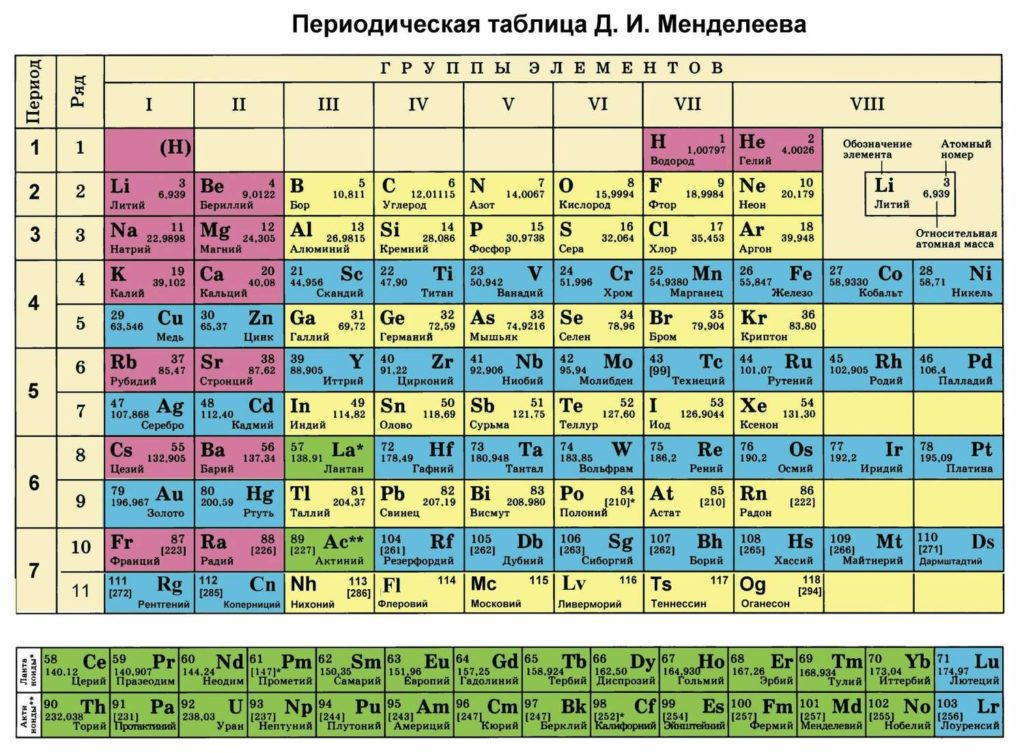
Каждый элемент размещается в периодической таблице согласно его атомному номеру. Этот номер, как мы уже говорили, представляет собой величину положительного электрического заряда атомного ядра, или, что то же самое, число отрицательных зарядов (электронов), вращающихся вокруг ядра.
В первом горизонтальном ряду, или периоде, таблицы Менделеева находятся два элемента — водород и гелий; во втором периоде — восемь элементов и столько же в третьем; затем восемнадцать элементов составляют четвертый период и еще восемнадцать — пятый.
В шестом периоде имеется восемнадцать элементов плюс четырнадцать лантанидов — итого тридцать два элемента. В современной периодической таблице есть седьмой период, который теоретически имеет места для восемнадцати элементов плюс четырнадцать актинидов, хотя, если ориентироваться на таблицу 1925 г., эта часть ее должна была бы выглядеть по-иному.
Если мы рассмотрим вертикальные колонки вместо горизонтальных рядов, то обнаружим в них элементы с одинаковыми химическими свойствами, расположенные один под другим. Группа I, например, включает водород и щелочные элементы, такие, как литий и натрий. Группа III включает скандий, иттрий и все лантанидные и актинидные элементы.
Крайняя справа группа — это благородные газы. Перед ней расположена группа галогенов (соль рождающих элементов), подобных фтору и хлору, каждый из которых имеет одно свободное место на своей внешней электронной оболочке.