Спирты (алкоголи) – класс органических соединений, содержащих одну или несколько группировок С–ОН, при этом гидроксильная группа ОН связана с алифатическим атомом углерода (соединения, у которых атом углерода в группировке С–ОН входит в состав ароматического ядра, называются фенолами). Спирты являются важным классом кислородсодержащих соединений, которые широко применяются в химической, пищевой, медицинской и косметической промышленности. Из статьи вы узнаете о основных физических и химических свойствах, способах получения спиртов и об особенностях этих соединений.
Классификация спиртов
В зависимости от количества гидроксильных групп в молекуле спирты делят на:
- одноатомные (содержат одну гидроксильную ОН-группу), например, метанол СН3ОН, этанол С2Н5ОН, пропанол С3Н7ОН
- многоатомные (две и более гидроксильных групп), например, этиленгликоль, глицерин.
По тому, с каким числом радикалов связан атом углерода, соединенный с группой ОН— спирты делят на:
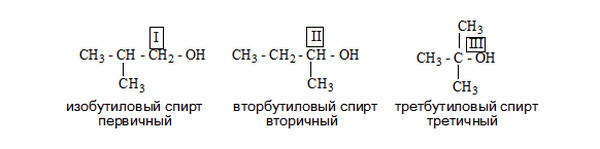
- первичные, у которых ОН-группа связана с первичным атомом углерода. Первичным называют атом углерода (выделен красным цветом), связанный всего с одним углеродным атомом. Примеры первичных спиртов – этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH.
- вторичные, у которых ОН-группа связана с вторичным атомом углерода. Вторичный атом углерода (выделен синим цветом) связан одновременно с двумя атомами углерода, например, вторичный пропанол, вторичный бутанол.
- третичные, у которых ОН-группа связана с третичным атомом углерода. Третичный углеродный атом (выделен зеленым цветом) связан одновременно с тремя соседними атомами углерода, например, третичный бутанол и пентанол.
По характеру связей радикала спирты бывают предельными, непредельными, ароматическими, алифатическими. В ароматических спиртах гидроксил связан не напрямую с бензольным кольцом, а через другой (другие) радикалы.
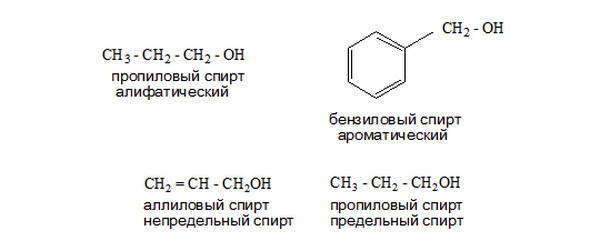
Соединения, в которых ОН— прямо связана с бензольным циклом, считаются отдельным классом фенолов.
Номенклатура спиртов
Для спиртов действуют рациональная, тривиальная и систематическая номенклатуры.
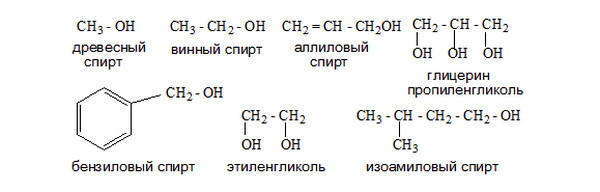
Рациональная номенклатура строится от метилового спирта или метанола, который в рациональной номенклатуре называется карбинол. Остальные спирты рассматриваются как производные карбинола, к которому присоединены различные радикалы. Названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», и цифрой показывающей место гидроксильной группы в цепи. Например, фенилкарбинол – бензиловый спирт (оксиметилбензол), этилкарбинол – пропиловый спирт (пропанол), винилкарбинол – пропен-2-ол-1 (аллиловый спирт).
Тривиальная номенклатура наиболее широко применяется. Для распространенных спиртов, имеющих простое строение, используют упрощенную номенклатуру: название органической группы преобразуют в прилагательное (с помощью окончания «овый») и добавляют слово «спирт» Метанол (метиловый спирт), пропиловый спирт, группа амиловых спиртов (С5) и т.д. Непредельные спирты практически только и называются тривиальными названиями – аллиловый и пропаргиловый спирты.
Систематическая номенклатура основана на выборе углеродной цепи и характеристике радикала. В систематической номенклатуре для одноатомных спиртов наличие гидроксильной группы указывается суффиксом -ол; для многоатомных -диол, триол и т.д. Суффикс -ол добавляется к названию углеводорода: метан — метанол, этан — этанол и т.д. Гидроксигруппа обозначается после галоидов, углеводородных радикалов и кратных связей. Положение гидроксигруппы обозначается наименьшим значением, если в составе молекулы отсутствует карбонильная и/или карбоксильная группа.
Систематические и тривиальные названия некоторых спиртов.
| Химическая формула спирта | Название по номенклатуре | Тривиальное название |
| CH3OH | Метанол | Древесный спирт |
| C2H5OH | Этанол | Винный спирт |
| C5H11OH | Пентан-1-ол | Амиловый спирт |
| C16H33OH | Гексадекан-1-ол | Цетиловый спирт |
Физические свойства
Низкомолекулярные спирты представляют собой бесцветные жидкости с резкими характерными запахами, кипящими при более высоких температурах, чем другие классы органических соединений.
Если рассмотреть гомологический ряд спиртов, то можно увидеть нечто общее для них – то, что среди них нет газов (в отличие от углеводородов). Все спирты жидкости. А так как молекула спирта полярна из-за наличия ОН-группы, то атом кислорода обладает частично отрицательным зарядом, атом водорода – частично положительным. Атом кислорода одной молекулы спирта может взаимодействовать с атомом водорода другой молекулы, имеющим положительный заряд. Образуется водородная связь. Водородные связи менее прочные, чем ковалентные, примерно в 10 раз. Но их много, поэтому молекулы спирта оказываются как бы “прилипшими” между собой, т.е. ассоциированными. Вот почему все спирты жидкости.
Химические свойства
Для спиртов можно выделить следующие реакции:
- Кислотно-основные;
- Дегидратация спиртов;
- Нуклеофильное замещение гидроксильной группы;
- Окисление спиртов.
Кислотные и основные свойства. Спирты способны проявлять себя как кислоты и как основания. Кислотность спиртов определяется строением алкильного радикала. Основные свойства спиртов проявляются по отношению к протонным и апротонным кислотам. Донором электронов в молекуле спирта является атом кислорода.
Взаимодействие с неорганическими кислотами. Спирты взаимодействуют с кислородсодержащими минеральными кислотами, реакция приводит к образованию сложных эфиров неорганических кислот. Многоосновные кислоты при взаимодействии со спиртами образуют кислые и средние эфиры. Высшие спирты, особенно вторичные и третичные, под действием серной кислоты легко образуют алкены и не образуют эфиров в таких условиях.
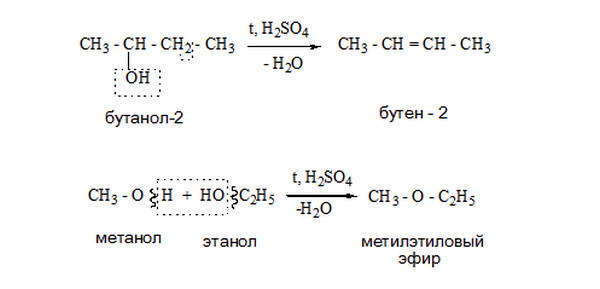
Дегитратация спиртов. Спирты вступают в реакции дегидратации (отщепление воды). Реакции отщепления протекают по внутримолекулярному и межмолекулярному типу с отщеплением воды и получением алкенов и простых эфиров.
Так, если этанол нагреть выше 170 ° С в присутствии концентрированной серной кислоты, происходит реакция внутримолекулярной дегидратации. Спирт превращается в ненасыщенный углеводород этилен: C2H5OH → CH2 = CH2 + H2O.
Если этанол нагреть только до температуры 140 ° С в присутствии концентрированной серной кислоты, происходит реакция межмолекулярного дегидратации. В результате ее образуются диэтиловый эфир и вода: C2H5OH + HOC2H5 → C2H5 — O — C2H5 + H2O.
Нуклеофильное замещение гидроксильной группы. К реакциям нуклеофильного замещения относятся замещение гидроксильной группы на галоген, амино-, алкоксигруппу и др. Гидроксид-анион, который выступает в роли уходящей группы, относится к числу трудно замещаемых групп. Чтобы осуществить нуклеофильное замещение гидроксильной группы в спиртах, последние необходимо модифицировать таким образом, чтобы гидроксид-анион не выступал в роли уходящей группы. Часто реакции проводят в присутствии сильных кислот, в этом случае гидроксильная группа протонируется и отщепляется в виде молекулы воды.
Реакции замещения спиртов протекают с образованием солей (алкоголятов и гликолятов металлов), сложных эфиров (этерификация с минеральными и карбоновыми кислотами), галогенопроизводных (гидрогалогенирование).
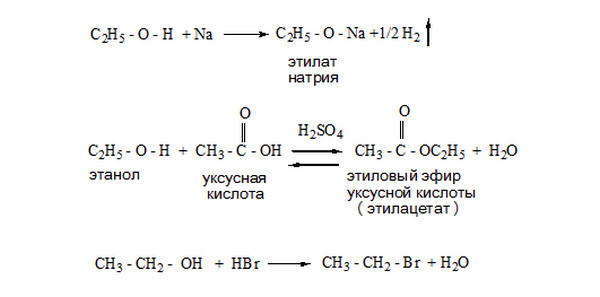
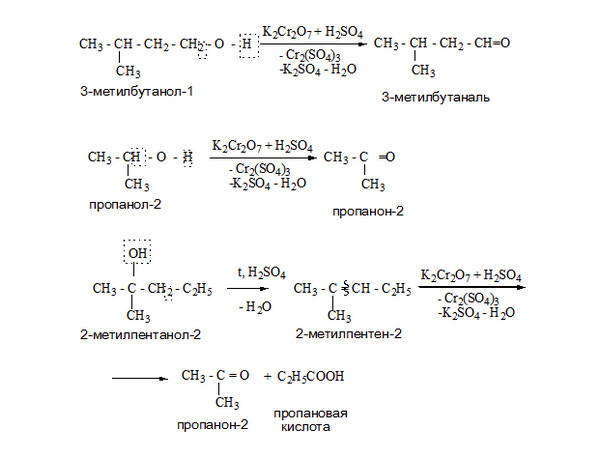
При окислении спиртов образуются оксосоединения (альдегиды и кетоны). Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот. При окислении вторичных спиртов образуются кетоны.
Спирты, как и все органические соединения, горят. Метанол и этанол мгновенно загораются при поджигании и горят синеватым, почти незаметным пламенем с выделением большого количества теплоты. Происходит реакция полного окисления, продуктами которой являются CO2 и H2O.
Получение
К наиболее часто используемым химическим способам получения спиртов относятся:
- нуклеофильное замещение атомов галогенов на гидроксильные группы в галогенпроизводных (щелочной гидролиз);
- гидратация алкенов (присоединение воды по кратным связям);
- восстановление карбонильных соединений, содержащих гидроксильную группу;
- синтез спиртов из альдегидов и кетонов;
- использование реакции Гриньяра;
- гидроксилирование по Вагнеру (мягкое окисление алканов и алкенов);
- гидролиз сложных эфиров карбоновых кислот;
- кислотное расщепление простых эфиров.
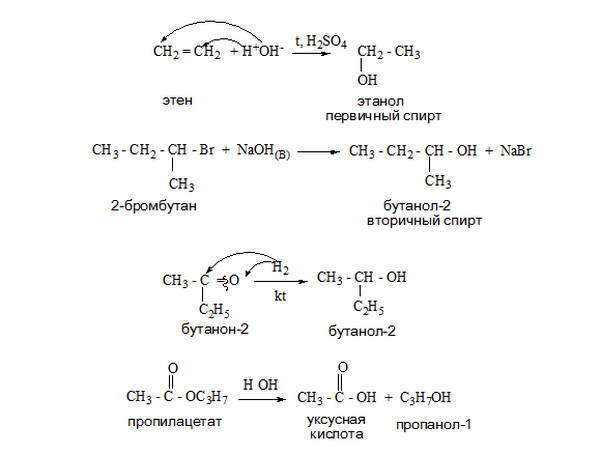
Все эти методы могут быть применены как в лабораторных условиях, так и в промышленном органическом синтезе. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при пропускании алкена с парами воды над фосфорнокислым катализатором. Другой общий способ получения спиртов — гидролиз алкилгалогенидов под действием водных растворов щелочей.
К биохимическим способам получения спиртов относится спиртовое сбраживание природного сырья, содержащего углеводы (крахмал, фруктозу, сахарозу и др.) Для промышленного получения спирта в качестве сырья используют содержащие крахмал продукты — картофель, зерновые культуры, а также отходы сахарного производства. Брожение протекает под действием дрожжей, в результате чего образуются этанол и другие предельные спирты (бутиловый, изобутиловый, амиловый и изоамиловый спирты), носящие название «сивушные масла», а также некоторых групп анаэробных бактерий, под действием которых образуется преимущественно н-бутиловый спирт. Этанол получают при спиртовом брожении глюкозы:
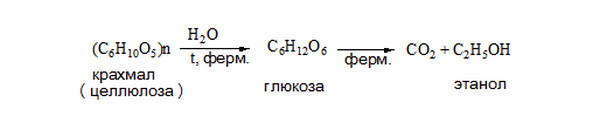
Многоатомные спирты получают из оксосоединений, алкенов, сложных эфиров многоосновных кислот.
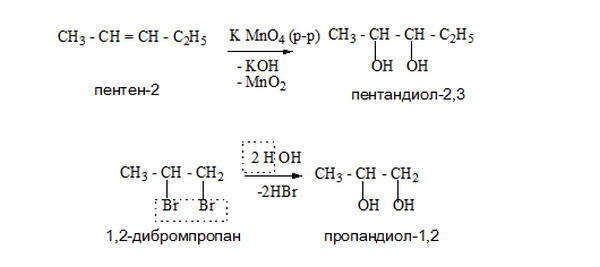
Одним из способов получения глицерина является омыление, гидролиз в кислой среде триацилглицеринов (сложные эфиры глицерина и высших жирных кислот) — основных компонентов липидной фракции жиров и растительных масел.
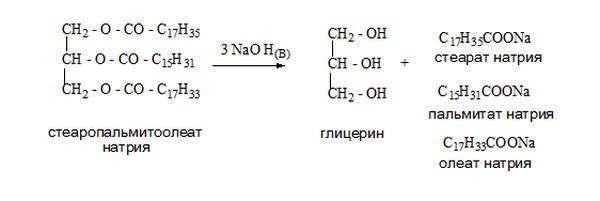
Применение
Этанол широко применяется в медицинской и пищевой промышленности, в производстве лекарств. Это основа алкогольных напитков, растворитель для эссенций. Другие спирты в основном используются, как растворители, и в качестве исходного сырья для синтеза простых и сложных эфиров.
Знаете ли вы, что еще в IV в. до н. э. люди умели изготавливать напитки, содержащие этиловый спирт? Вино получали сбраживанием фруктовых и ягодных соков. Однако выделять из него дурманящий компонент научились значительно позже. В чистом виде этанол был выделен из вина арабами примерно в VI-VII веках, а европейцами — на пять столетий позже. Алхимики уловили пары летучего вещества, которое выделялось при нагревании вина и научились конденсировать их, получив спирт.
Спирты используют также как биотопливо, добавку в топливо, ингредиент тормозной жидкости, гидравлических жидкостей.
